List ao Articles with: Ossidazione
Ossigeno: singoletto e tripletto
Come abbiamo visto in precendeza l’ossigeno è una molecola abbastanza instabile. Ciò deriva dal fatto che in natura si presenta in forme molecolari diverse ovvero come ossigeno singoletto e ossigeno tripletto.[banner]
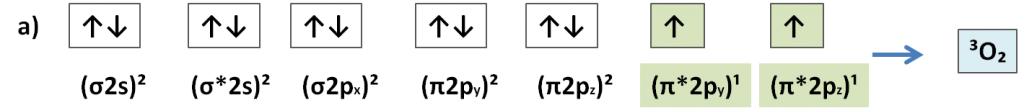
Questi due termini si relazionano al legame chimico (covalente) che sussiste tra 2 atomi di ossigeno. L’ossigeno molecolare presenta 12 elettroni di valenza nel guscio esterno suddivisi in 7 orbitali. Di questi orbitali 5 sono degeneri ovvero isoenergetici (in quanto presentano elettroni accoppiati con spin opposti) mentre gli altri 2 possono presentarsi con una diversa forma di degenerazione. Lo stato fondamentale dell’ossigeno è quello che identifica la condizione di tripletto a) ma essa non si verifica quasi mai. La condizione di tripletto si deduce dalla disposizone elettronica mostrata in figura e che individua la molteplicita (S) =3 dove appunto S= 2s + 1 e dove s è la somma degli spin elettronici (ognuno vale +1/2) e quelli
(ognuno vale -1/2). Questo livello di energia molto basso non si presenta in natura ed è solo una predizione teorica tuttavia comunque lo stato di tripletto ha una probabilità non nulla di verificarsi nell’ossigeno.
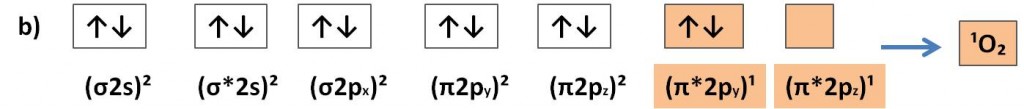
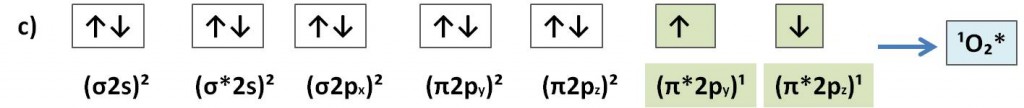
In genere l’ossigeno si presenta più spesso con altre 2 condizioni elettroniche in cui lo stato fondamentale è definito singoletto (molteplicità S=1). In questo stato di singoletto, gli elettroni esterni sono accoppiati con spin antiparallelo. I particolare l’ossigeno nello stato fondamentale può trovarsi in 2 stati eccitati di singoletto: nel primo caso gli ultimi due orbitali degeneri (isoenergetici) possono essere accoppiati con spin antiparalleli ma presentando un orbitale vuoto b) oppure possono presentarsi con spin opposti ma in orbitali diversi c).
Questi stati eccitati in genere scompaiono appena formati e pertanto ciò implica che possono essere estremamente reattivi. In effetti tra le due condizioni eccitate, lo stato che presenta un orbitale vuoto b) è quello maggiormente rettivo con le specie chimiche vicinali in quanto cerca di riempire l’orbitale vuoto di antilegame. Proprio per questo nelle reazioni di perossidazione lipidica la nuvola elettronica del gruppo metilenico si sposta nell’orbitale vuoto dell’ossigeno, innescando in questo modo la modificazione strutturale degli acidi grassi.
Queste nozioni potrebbero sembrare poco pertinenti con il problema dell’ossidazione dei composti alimentari (e non solo), ma ci permettono di comprendere fino in fondo i meccanismi che sono alla base delle evoluzioni chimico-fisiche a cui sono sottoposte tutte le matrici organiche che interagiscono poi col nostro organismo dopo l’ingestione.